Суфер®
Суфер® ‒ внутривенный препарат железа для быстрой клинической и гематологической коррекции дефицита гемоглобина:
- в 2 раза быстрее по сравнению с другими формами препаратов железа;
- на 25% меньшая потребность в эритропоэтине при комбинированном применении.
Действующее вещество: 1 мл раствора содержит 20 мг железа в виде железа (ІІІ) гидроксид-сахарозного комплекса.
Показания.
Железодефицитные состояния:
- при необходимости быстрого восполнения железа;
- пациентам, которые не переносят пероральных препаратов железа или не соблюдают их регулярного приема;
- при наличии активных воспалительных заболеваний пищеварительного тракта, когда пероральные препараты железа неэффективны.
Форма выпуска: по 5 мл в ампулы стеклянные № 5 в контурно-ячеистой упаковке; по 1 контурно-ячеистой упаковке в пачке из картона.
Форма выпуска
Рынки сбыта
Таджикистан, Узбекистан, Украина.
Инструкция
«ОДОБРЕНО»
ГУП «Государственный центр экспертизы и
стандартизации лекарственных средств,
изделий медицинского назначения и
медицинской техники»
Агенства по развитию фармацевтической
отрасли при Министерстве здравоохранения
Республики Узбекистан
ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ
СУФЕР®
Торговое название препарата: Суфер®
Действующее вещество (МНН): Iron Sucrose
Лекарственная форма: раствор для внутривенных инъекций
Состав:
1 мл раствора содержит:
активное вещество: железа (III)-гидроксид сахарозный комплекс, что эквивалентно
содержанию железа – 20 мг;
вспомогательное вещество: вода для инъекций.
Описание: водный раствор темно-коричневого цвета.
Фармакотерапевтическая группа. антианемические средства для парентерального
введения. Препараты железа
Код АТХ: В03АС02
Фармакологические свойства
Фармакодинамика
Механизм действия
Активный компонент препарата Суфер® – железа (III)-гидроксид сахарозный комплекс – состоит из многоядерного центра железа (III)-гидроксида, окруженного большим количеством нековалентно связанных молекул сахарозы. Средняя молекулярная масса (Мr) этого комплекса составляет примерно 43 кДа. Многоядерный центр железа имеет структуру, подобную структуре центра белка ферритина, который является физиологическим депо железа. Этот комплекс предназначен для создания управляемого источника утилизируемого железа для белков, отвечающих за транспорт и депонирование железа в организме (трансферрин и ферритин соответственно).
После внутривенного введения многоядерный центр железа из комплекса захватывается преимущественно ретикулоэндотелиальной системой печени, селезенки и костного мозга. На следующем этапе железо используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов, или хранится в печени в виде ферритина.
Клинические исследования показали, что гематологический ответ при внутривенном введении железа (III)-гидроксид сахарозного комплекса наблюдается быстрее чем при применении пероральных растворимых форм железа.
Фармакокинетика
Распределение
Оценка ферокинетики железа (III)-гидроксид сахарозного комплекса, меченого 59Fe и 52Fe, проводилась среди 6 пациентов с анемией и хронической почечной недостаточностью. В течение первых 6–8 часов 52Fe захватывался печенью, селезенкой и костным мозгом.
Считается, что захват радиоактивной метки селезенкой, богатой макрофагами, является типичным для захвата железа ретикулоэндотелиальной системой.
После внутривенного введения здоровым добровольцам разовой дозы препарата Суфер®, содержащей 100 мг железа, максимальная концентрация железа наблюдалась через 10 минут после введения и достигала среднего значения 538 ммоль/л. Объем распределения центральной камеры соответствовал объему плазмы (примерно 3 литра).
Биотрансформация
После инъекции сахароза почти полностью распадается, и многоядерный центр железа захватывается преимущественно ретикулоэндотелиальной системой печени, селезенки и костного мозга.
Через 4 недели после введения усвоение железа эритроцитами колеблется от 68 % до 97 %.
Выведение
Средняя молекулярная масса (Мr) железа (III)-гидроксид сахарозного комплекса составляет примерно 43 кДа, что является достаточно высоким показателем и не позволяет его выведение почками. Выведение железа почками в течение первых 4 часов после инъекции 100 мг препарата составляло менее 5 % введенной дозы. Через 24 часа общая концентрация железа в сыворотке крови была уменьшена до начального уровня (перед введением), а выведение сахарозы почками составляло примерно 75 % введенной дозы.
Фармакокинетика у отдельных групп пациентов
На сегодняшний день неизвестно, влияет ли почечная и печеночная недостаточность на фармакологические свойства железа (III)-гидроксид сахарозного комплекса (см. раздел «Особые указания»).
Показания к применению
Дефицит железа у пациентов, которым не могут быть назначены пероральные препараты железа или при их неэффективности в следующих случаях:
- непереносимость пероральных препаратов железа;
- воспалительные заболевания желудочно-кишечного тракта (например, язвенный колит), которые могут обостряться при терапии пероральными препаратами железа;
- железодефицитные состояния, резистентные к терапии, в случае, когда контроль этих состояний пероральными препаратами железа недостаточен.
Суфер® следует применять только в тех случаях, когда показание к применению подтверждено результатами соответствующих лабораторных исследований (например, определение уровня гемоглобина (Hb), сывороточного ферритина, насыщения трансферрина железом).
Способ применения и дозы
Суфер® вводится внутривенно, медленно.
Препарат не предназначен для подкожного или внутримышечного введения.
Во время и после применения препарата Суфер® следует наблюдать за пациентами для своевременного выявления признаков и симптомов реакций гиперчувствительности.
Необходимо обеспечить все необходимое для оказания соответствующей неотложной помощи (см. раздел «Особые указания»).
Кумулятивную дозу препарата следует рассчитывать для каждого пациента индивидуально и нельзя ее превышать. Расчет дозы зависит от массы тела пациента и уровня Hb.
В случае, когда общая необходимая доза превышает максимальную разрешенную разовою дозу 200 мг (для инъекции) или 500 мг (для инфузии), ее рекомендуется разделить на несколько введений.
Расчет дозы
Общая кумулятивная доза препарата Суфер®, эквивалентная общему дефициту железа (мг), определяется на основании уровня Hb и массы тела пациента. Дозу рассчитывают индивидуально в соответствии с общим дефицитом железа в организме пациента по формуле
Ганзони:

Общий объем препарата Суфер®, который необходимо ввести (в мл), учитывая массу тела пациента и уровень Hb пациента:
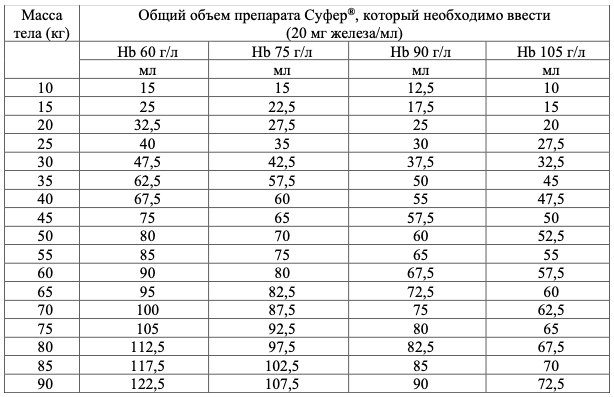
Целевой уровень Hb в зависимости от массы тела пациента:
![]()
Для перевода Hb (ммоль) в Hb (г/л) следует умножить первое значение на 16.
В случае, когда общая необходимая доза превышает максимальную разрешенную разовую дозу 200 мг (для инъекции) или 500 мг (для инфузии), ее рекомендуется разделить на несколько введений.
Стандартная дозировка
Взрослые
5–10 мл препарата Суфер® (100–200 мг железа) 1–3 раза в неделю. Длительность применения и коэффициент разведения см. ниже.
Дети старше 3 лет
Есть лишь ограниченные данные о применении препарата у детей. В случае клинической необходимости рекомендуется не превышать дозу 0,15 мл препарата Суфер® (3 мг железа) на 1 кг массы тела пациента и вводить не более 3 раз в неделю. Длительность применения и коэффициент разведения см. ниже.
Максимальная переносимая разовая или недельная доза
Взрослые
• Для инъекции максимальная переносимая доза, которую вводят не более 3 раз в неделю,
составляет 10 мл препарата Суфер® (200 мг железа), продолжительность введения – не менее
10 минут.
• Для инфузии максимальная переносимая доза, которую вводят не более 1 раза в неделю:
- пациентам с массой тела более 70 кг – 500 мг железа (25 мл препарата Суфер®) в течение не менее 3,5 часов;
- пациентам с массой тела 70 кг и менее – 7 мг железа на 1 кг массы тела в течение не менее 3,5 часов.
Следует строго соблюдать время введения инфузии, даже если пациент не получает максимальной переносимой разовой дозы.
В случае отсутствия улучшения гематологических показателей (повышение уровня Hb примерно на 1 г/л крови в день или примерно на 10–20 г/л через 1–2 недели после начала лечения), следует пересмотреть первоначальный диагноз пациента и исключить наличиеустойчивой кровопотери.
Способ применения
Суфер® можно вводить только внутривенно, путем капельной инфузии, медленной инъекции, или непосредственно в венозный участок диализной системы. Суфер® не предназначен для внутримышечного или подкожного введения.
В случае, когда общая необходимая доза превышает максимальную разрешенную разовою дозу 200 мг (для инъекции) или 500 мг (для инфузии), ее рекомендуется разделить на несколько введений.
Внутривенное капельное введение
Непосредственно перед введением препарат Суфер® необходимо развести только в 0,9 % растворе натрия хлорида по следующей схеме:
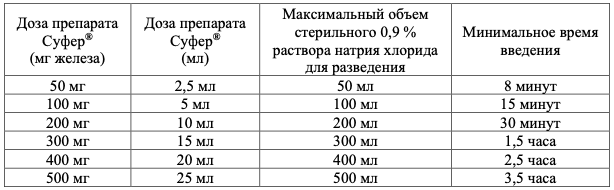
Внутривенное струйное введение
Суфер® можно также вводить внутривенно медленно в виде неразбавленного раствора со скоростью 1 мл в минуту, но максимальный объем раствора не должен превышать 10 мл препарата (200 мг железа) за 1 инъекцию. После инъекции пациенту следует выпрямить руку.
Следует избегать паравенозного введения препарата, поскольку это может приводить к возникновению боли, воспалению, некрозу тканей и длительному окрасу кожи в коричневый цвет (см. раздел «Особые указания»).
Инъекционное введение в венозный участок диализной системы
Суфер® можно вводить непосредственно в венозный участок диализной системы в течение сеанса гемодиализа, строго соблюдая правила проведения внутривенной инъекции.
Побочные действия
Наиболее частой побочной реакцией во время клинических исследований была дисгевзия, которая возникала с частотой 4,5 случая на 100 человек. К другим частым нежелательным реакциям относились тошнота, артериальная гипотензия, артериальная гипертензия, боль в месте инъекции, которые возникали с частотой от 1 до 2 случаев на 100 человек.
Основными серьезными побочными реакциями, связанными с применением железа (III)-гидроксид сахарозного комплекса, являются реакции гиперчувствительности, которые возникали во время клинических исследований с частотой 0,25 случая на 100 человек. Реакции гиперчувствительности немедленного типа (анафилактоидные анафилактические реакции) возникали редко. Как правило, анафилактоидные/анафилактические реакции – это очень серьезные побочные реакции, которые могут быть летальными (см. раздел «Особые указания»). Симптомы включают нарушение кровообращения, артериальную гипотензию, тахикардию, респираторные симптомы (бронхоспазм, отек глотки и гортани, и т. д.), симптомы со стороны желудочно-кишечного тракта (абдоминальная боль, рвота и т. д.), симптомы со стороны кожи (крапивница, эритема, зуд т. д.).
Побочные реакции по частоте возникновения классифицируют по таким категориям: очень часто (≥ 1/10), часто (≥ 1/100, < 1/10), нечасто (≥ 1/1000, < 1/100), редко (≥ 1/10000, < 1/1000), очень редко (< 1/10000), неизвестно (доступные данные не позволяют оценить частоту, поскольку о таких явлениях сообщалось исключительно в течение постмаркетинговых исследований, а не клинических испытаний).
Со стороны иммунной системы
Нечасто: реакции гиперчувствительности.
Нарушения обмена веществ, метаболизма
Нечасто: повышение уровня ферритина в сыворотке крови.
Со стороны нервной системы
Часто: дисгевзия, головокружение.
Нечасто: головная боль, парестезия, гипестезия.
Редко: потеря сознания, сонливость.
Со стороны сердца
Нечасто: артериальная гипотензия и коллапс, тахикардия.
Редко: сердцебиение.
Неизвестно: синдром Коуниса.
Со стороны сосудистой системы
Часто: артериальная гипотензия, артериальная гипертензия.
Нечасто: ощущение жара, флебит.
Неизвестно: тромбофлебит поверхностных вен в месте инъекции.
Со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: одышка.
Со стороны почек и мочевыделительной системы
Нечасто: хроматурия.
Со стороны желудочно-кишечного тракта
Часто: тошнота.
Нечасто: рвота, абдоминальная боль, диарея, запор.
Со стороны гепатобилиарной системы
Нечасто: повышение уровня аланинаминотрансферазы, повышение уровня аспартат- аминотрансферазы, повышение уровня гамма-глутамилтрансферазы.
Редко: повышение уровня лактатдегидрогеназы в крови.
Со стороны кожи и подкожной клетчатки
Нечасто: зуд, сыпь.
Со стороны опорно-двигательной системы и соединительной ткани
Нечасто: мышечные спазмы, миалгия, артралгия, боль в конечностях, боль в спине.
Общие нарушения и реакции в месте введения
Часто: реакции в месте инъекции/инфузии1.
Нечасто: боль в груди, озноб, астения, усталость, периферические отеки, боль.
Редко: повышенная потливость, лихорадка.
1 Наиболее частыми побочными эффектами являются: боль в месте инъекции/инфузии, экстравазация,
раздражение и изменении цвета кожи в месте инъекции/инфузии, гематома, зуд.
Следующие побочные реакции, полученные из отчетов постмаркетингового наблюдения
Частота неизвестна: нарушение сознания, брадикардия, тромбофлебит.
Сообщение о подозреваемых побочных реакциях
Сообщение о подозреваемых побочных реакциях после регистрации лекарственного средства является важной процедурой. Это позволяет продолжать мониторинг соотношения польза/риск для соответствующего лекарственного средства. Медицинским работникам необходимо сообщать о любых подозреваемых побочных реакциях через национальную систему фармаконадзора.
Противопоказания
- Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ;
- анемия, не связанная с дефицитом железа (например, гемолитическая анемия, мегалобластическая анемия вследствие недостаточности витамина В12, нарушения эритропоэза, гипоплазия костного мозга, анемия, вызванная отравлением свинцом);
- перенасыщение организма железом (гемосидероз, гемохроматоз) или наследственные нарушения утилизации железа (сидероахрестическая анемия, талассемия, поздняя кожная порфирия);
- I триместр беременности.
Лекарственные взаимодействия
Суфер® показан только тем пациентам, которым не могут быть назначены пероральные препараты железа или при их неэффективности. В этом случае Суфер® не следует применять одновременно с железосодержащими пероральными средствами, поскольку абсорбция железа, применяемого внутрь, снижается.
Несовместимость
Суфер® можно смешивать только со стерильным 0,9 % раствором натрия хлорида в асептических условиях. Никаких других растворов для внутривенного введения и терапевтических препаратов добавлять не разрешается, поскольку существует риск преципитации и/или иного фармацевтического взаимодействия. Совместимость с контейнерами из полиэтилена и поливинилхлорида не изучена.
Особые указания
Внутривенное применение парентеральных препаратов железа может привести к возникновению реакций гиперчувствительности немедленного типа (анафилактические/ анафилактоидные реакции), которые потенциально могут быть летальными. Сообщали о развитии таких реакций даже в случаях, когда предыдущее применение препаратов железа для парентерального введения проходило без осложнений. Сообщали о реакциях гиперчувствительности, которые прогрессировали до синдрома Коуниса (острый аллергический спазм коронарных артерий, который может спровоцировать развитие инфаркта миокарда, см. раздел «Побочные действия»). Пациентам, у которых возникали реакции гиперчувствительности при применении декстрана железа, препарат Суфер® следует применять только в случае крайней необходимости, приняв все меры предосторожности.
Лечение препаратом Суфер® должен назначать только врач после точного определения показания. Суфер® можно вводить только в том случае, когда медицинский персонал имеет навыки оценки и лечения анафилактических реакций, и при наличии всех необходимых средств и оборудования для проведения реанимационных мероприятий. Перед каждым введением препарата Суфер® необходимо проводить опрос пациента относительно побочных реакций, связанных с предыдущим применением внутривенных препаратов железа.
Типичными симптомами реакций гиперчувствительности являются: снижение артериального давления, тахикардия (вплоть до анафилактического шока), респираторные симптомы (бронхоспазм, отек глотки и гортани и т. д.), симптомы со стороны желудочно-кишечного тракта (абдоминальные спазмы, рвота и т.д.) или симптомы со стороны кожи (крапивница, эритема, зуд).
Пациенты должны находиться под наблюдением не менее 30 минут после введения парентеральных препаратов железа для своевременного выявления признаков и симптомов реакций гиперчувствительности. В случае возникновения аллергических реакций или признаков непереносимости в течение применения лекарственного средства следует немедленно прекратить лечение.
Для немедленного лечения острых анафилактических/анафилактоидных реакций прежде всего рекомендуется применение адреналина, например, в дозе 0,3 мг внутримышечно. Затем можно применить антигистаминные препараты и/или кортикостероиды (имеют более позднее начало действия).
Риск развития реакций гиперчувствительности повышается у пациентов с аллергией в анамнезе, включая непереносимость лекарственных средств, бронхиальную астму тяжелой степени, экзему и другие формы атопии, а также у пациентов с иммунологическими и воспалительными заболеваниями (например, системная красная волчанка, ревматоидный артрит).
Пациентам с нарушением функции печени препараты железа для парентерального введения следует применять после тщательной оценки соотношения польза/риск. Следует избегать парентерального введения железа пациентам с нарушенной функцией печени, когда перенасыщение железом является провоцирующим фактором. Рекомендуется проводить тщательный мониторинг содержания железа во избежание перенасыщения.
У пациентов с повышенным уровнем ферритина препараты железа для парентерального введения могут негативно влиять на ход бактериальной или вирусной инфекции.
Препараты железа для парентерального введения следует применять с осторожностью в случае острой или хронической инфекции. У пациентов с хронической инфекцией следует проводить оценку соотношения польза/риск. Рекомендуется прекратить применение препарата Суфер® пациентам с бактериемией.
Следует избегать паравенозного введения препарата, поскольку это может приводить к возникновению боли, воспалению, некрозу тканей и длительному коричневому окрасу кожи в месте инъекции. В этом случае следует немедленно прекратить введение препарата.
Клинические исследования с применением железа (III)-гидроксид сахарозного комплекса не показали развития некроза тканей.
Часто наблюдается снижение артериального давления при применении препаратов железа для внутривенного введения. Поэтому раствор необходимо вводить с осторожностью.
Следует соблюдать особую осторожность при применении препарата Суфер® пациентам с нарушением функции печени, декомпенсированным циррозом печени, эпидемическим гепатитом, болезнью Рандю – Ослера – Вебера, с острыми инфекционными заболеваниями почек, неконтролируемым гиперпаратиреоидизмом.
Перед применением ампулы следует осмотреть на наличие осадка и повреждений.
Применять можно только водный раствор коричневого цвета, не содержащий осадок.
Суфер® следует вводить немедленно после вскрытия ампулы.
Применение при беременности в период лактации
Беременность
Нет достаточных данных по применению железа (III)-гидроксид сахарозного комплекса в I триместре беременности. Данные по применению железа (III)-гидроксид сахарозного комплекса во II и III триместрах беременности (303 сообщения о беременности) показали отсутствие нежелательного влияния на здоровье матери или новорожденного.
До сих пор неизвестно, проникает ли железа (III)-гидроксид сахарозный комплекс через плаценту. Однако железо, связанное с трансферрином, проникает через плацентарный барьер, а железо, связанное с лактоферрином, проникает в грудное молоко.
Исследования по влиянию на уровень железа у новорожденных не проводились.
Препарат Суфер® противопоказано применять в I триместре беременности (см. раздел «Противопоказания»). Возможно применение препарата во II и III триместрах беременности только строго по показаниям.
Следует оценивать соотношение польза/риск перед применением препарата в период беременности, поскольку реакции гиперчувствительности могут нести определенный риск для матери и ребенка (см. раздел «Особые указания»). Следует учитывать данные по массе тела до начала беременности для расчета необходимого количества железа, чтобы избежать передозировки.
После введения беременной парентеральных форм железа у плода может развиться брадикардия. Обычно это состояние транзиторное и возникает как следствие реакции гиперчувствительности у матери. При внутривенном введении препаратов железа беременным, следует тщательно контролировать состояние плода.
Период кормления грудью
Данные по экскреции железа в грудное молоко после введения железа (III)-гидроксид сахарозного комплекса ограничены. Во время клинического исследования 10 здоровых женщин с железодефицитным состоянием, которые кормили грудью, получали 100 мг железа в форме железа (III)-гидроксид сахарозного комплекса. После четырех дней лечения показатель содержания железа в грудном молоке не увеличился и не отличался от такового в контрольной группе (n = 5). Нельзя исключать влияние железа, поступающего с грудным молоком матери, на новорожденного младенца, поэтому следует оценивать соотношение польза/риск при применении препарата.
Дети
Учитывая недостаточность данных, не рекомендуется применение препарата Суфер® для
лечения детей в возрасте до 3 лет.
Влияние на способность управлять автомобилем и сложными механизмами
Соответствующие исследования отсутствуют. Влияние на скорость реакции при управлении
автотранспортом или другими механизмами маловероятно. Но в случае развития побочных
реакций, таких как головокружение, спутанность сознания, следует воздержаться от
управления автотранспортом или работы с механизмами до исчезновения симптомов.
Передозировка
Передозировка может привести к острому перенасыщению организма железом, что может проявиться как гемосидероз. В случае передозировки рекомендуется применять симптоматическую терапию и, если необходимо, вещества, связывающие железо (хелаты).
Форма выпуска
По 5 мл в ампулы стеклянные № 5 в контурно-ячеистой упаковке; по 1 контурно-ячеистой упаковке в пачке из картона.
Условия хранения
Хранить в защищенном от света месте.
Хранить при температуре не выше 25 °С.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности.
Срок годности после вскрытия ампулы. С микробиологической точки зрения препарат
следует применять немедленно.
Срок годности после разведения физиологическим раствором. Химическая и физическая
стабильность после разведения при комнатной температуре составляет 12 часов.
Условия отпуска из аптек
По рецепту.
Производитель:
ООО «Юрия-Фарм».
Местонахождение производителя
Украина, 18030, Черкасская обл., г. Черкассы, ул. Кобзарская, 108.
Тел.: +38 (044) 281-01-01.
Наименование и адрес организации, принимающей претензии (предложения) по
качеству лекарственных средств на территории Республики Узбекистан:
ООО «Юрия-Фарм»
Республика Узбекистан, г. Ташкент, Мирабадский район, улица Нукус, дом 71.
Тел.: 78 150 71 00.